目次
非小細胞肺がんでは、腺がん・扁平上皮がん・大細胞がんといった組織型、進行の程度であるステージ(病期)、EGFRやKRASなどの遺伝子異常の有無、ご本人の体の状態などを総合的に検討し、決められます。
非小細胞肺がんの組織型
組織型が違っても、基本的な治療の流れに大きな違いはありません。
- 腺がん
肺がんの中で最も発生頻度が高く、喫煙の習慣がない人や女性に多く認められます。 - 扁平上皮がん
肺の中の扁平上皮細胞に発生するがんで、喫煙者に多く認められます。 - 大細胞がん
比較的珍しいタイプで、肺の末梢に発生することが多く、薬物療法や放射線療法の効果が得られにくい傾向にあります。
非小細胞肺がんの治療方針
非小細胞肺がんの治療は、手術・放射線療法・薬物療法があり、状況に応じて単独あるいは、組み合わせて治療が行われます。
治療方針はステージ(病期)ごとにガイドラインで定められています。
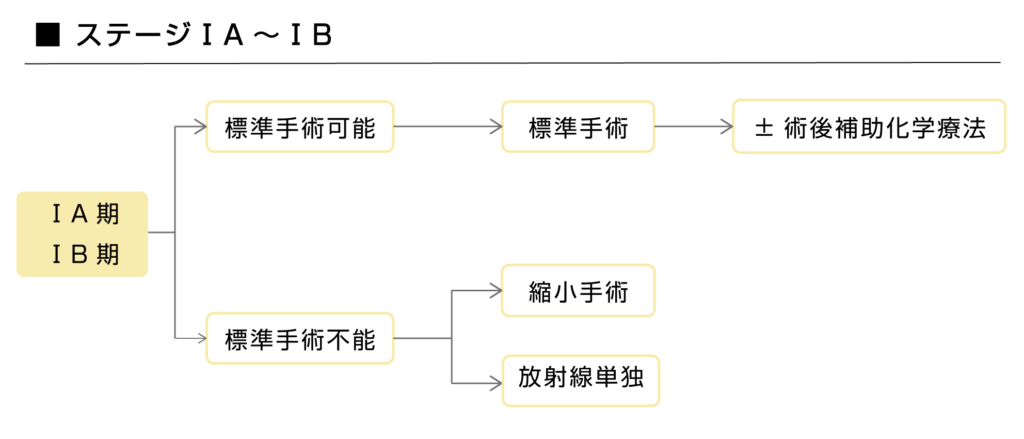
がんが肺の一部にとどまっているステージ1A~1Bまでは、手術で根治を目指します。
しかし、医学的な理由などにより手術ができない場合は、肺がんがある一部のみを切除する縮小手術や、治癒を目標とした放射線治療が検討されます。
※肺尖部胸壁浸潤癌:肺尖部に発生し周囲胸壁に浸潤した癌
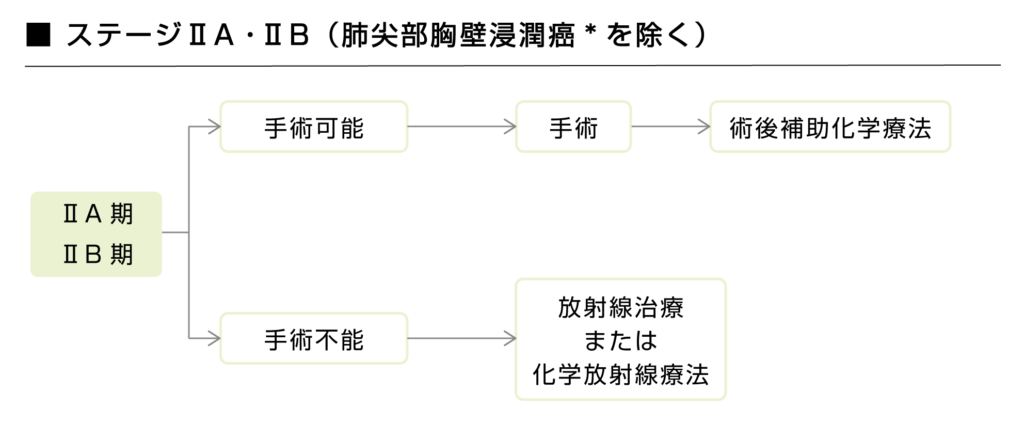
ステージ2Aまたは2Bでは、手術でほとんどのがん細胞を切除できますが、画像検査では分からないような微小な転移がある可能性もあるため、再発リスクを下げるためにも術後補助化学療法がすすめられています。
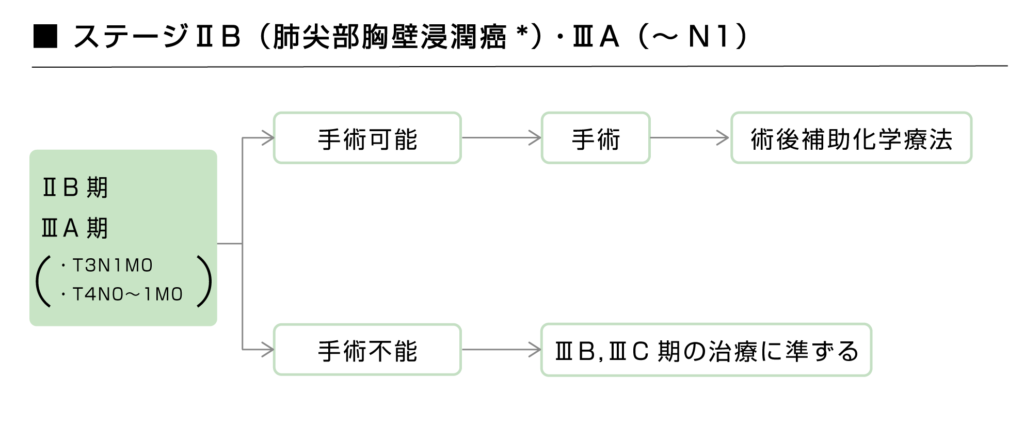
※肺尖部胸壁浸潤癌:肺尖部に発生し周囲胸壁に浸潤した癌
ステージ2Bの肺尖部胸壁浸潤癌とステージ3A(T3N1M0、T4N0~1M0)の非小細胞肺がんは手術可能であれば手術を行い、再発リスクを下げるために術後に補助化学療法が行われます。
手術ができない場合は、ステージ3B・3Cのガイドラインに準じて治療が行われます。
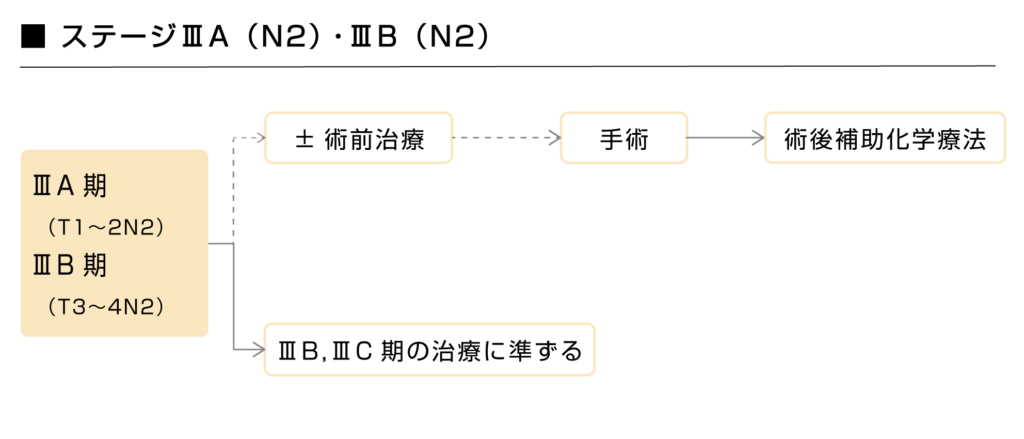
リンパ節転移がN2のステージ3A・3Bにおいては、基本的にはステージ3B・3Cのガイドラインに準じて治療が行われます。
また、切除可能だと判断されるリンパ節転移がN2のステージ3A・3Bの非小細胞肺がんに対しては術前治療として化学放射線療法や化学療法を行ってから手術という治療方針が示されることもありますが、有効性と安全性が確立しておらず、副作用や思ったよりも癌が進行してしまい、手術が出来なくなるなどの結果となることもあるので、慎重に検討する必要があります。
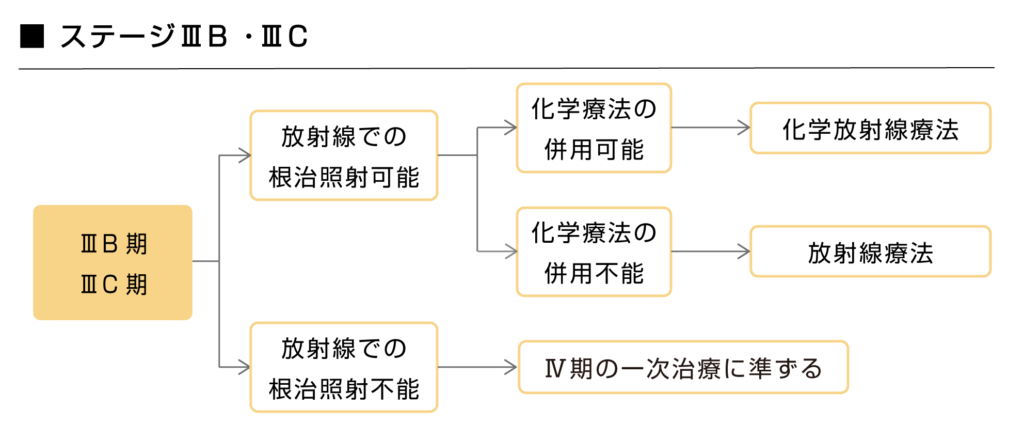
手術が適応とならないステージ3B・3Cの非小細胞肺がんに対しては、放射線治療による根治照射が可能と判断された場合は放射線治療が治療の中心となります。
PS※が0~1の全身状態が良好な患者さんに対しては、化学療法を併用する化学放射線療法が推奨されています。全身状態が良くないなどの理由から化学療法との併用不能と判断された場合は放射線単独療法が推奨されます。
放射線療法による効果が期待できないと判断された時は、ステージ4のガイドラインに準じて治療が行われます。
※PS(パフォーマンスステータス):全身状態を示す指標
※肺癌診療ガイドライン2022年版を参考に作成
遠隔転移があったり、肺や心臓のまわり水が溜まっている進行肺がんには、すでにがん細胞が血液に乗って全身に広まっています。
そのため、放射線や手術といった局所治療は適応とならず、全身に効果のある薬物療法(抗がん剤・分子標的治療薬・免疫チェックポイント阻害薬)での治療となります。
非小細胞肺がんの増殖や発生には様々な遺伝子が関連していることがわかっており、薬物療法に入る前に患者さんの遺伝子変異を調べ、各遺伝子異常に対応した分子標的治療薬で治療を行うことで、より高い効果が期待できるようになりました。
いずれの遺伝子変異も認められなかった場合も、PD-L1検査を行い、その結果を考慮して従来の抗がん剤や免疫チェックポイント阻害薬による治療が行われます。
使う薬剤は、患者さんのPSや年齢などを総合的に見て、決められます。
非小細胞肺がんの外科治療
非小細胞肺がんでは、ステージ1~2と3Aの一部までが手術の対象となります。手術を行うかどうかは、ステージだけでなく、肺がんの発生場所うや患者さんの全身状態、心肺機能の状態、既往歴も十分に考慮して決められます。
肺は右肺と左肺に分かれており、右肺には3つ(上葉・中葉・下葉)左肺には2つ(上葉・下葉)の肺葉が存在します。
切除する範囲で手術の種類は異なります。
1)肺葉切除術
がんのある肺葉を切除する手術で、非小細胞肺がんでは最も多く行われている手術方法です。
通常は周囲所リンパ節も同時に切除するリンパ節郭清も行われます。肺と隣接する胸壁や
心膜までがんが広がっている時は、同時に切除する場合があります。
2)縮小手術
縮小手術は、ステージB1までの早期の肺がんで、肺機能に問題があり肺葉切除ができない患者さんなどに対して、肺をできるだけ温存することを目的に行われます。
縮小手術には、がんとその周囲のみを部分的にくり抜く、「楔状切除」や肺葉の中の肺がんがある区域のみを切除する「区域切除」があり、どの範囲を切除するか、縮小手術を行うかどうかは新党に決定されます。
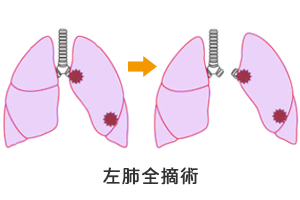
3)片側肺全摘手術
がんがある側の肺を全摘する手術で、病巣が大きく複数の肺葉を巻き込んでいる場合や大血管や気管支に及んでいる場合に行われることがあります。
基本的にリンパ節郭清も同時に行われ、がんが肺と隣接している胸壁や心膜まで広がっている時は、これらも一緒に切除する場合があります。
体への負担も大きいので、心肺機能を考慮しながら手術できるかどうかが検討されます。
■手術後の過ごし方
術後は2~4日後は肺を取った所に溜まる血液や体液、空気を体外に出すために胸腔内にドレーンを挿入します。
大きな問題がなければ、手術の翌日には食事や歩行が可能となります。術後の合併症を防ぎ、回復を早めるためにもできるだけ早くベッドから起き上がり、歩く練習をすることが大切です。
非小細胞肺がんの放射線療
局所的な治療である放射線療法は根治を目的とするだけでなく、痛みなどの症状緩和、転移や再発を予防する目的で、単独あるいは化学療法と併用で行われます。
近年は放射線治療も発展しており、IMRT(強度変調放射線治療)やSRT(定位放射線治療)、IGRT(画像誘導放射線治療)の普及で、より治療成績は上がってきています。
放射線療法の副作用
放射線を当てた部分が日焼けしたように炎症を起こす皮膚炎、食道に炎症が起こりチクチク痛んだりする食道炎、治療の半ばから咳や熱、息切れの症状が出る肺臓炎などが現れることがあります。また、治療を終了してから半年間ほどは放射線肺炎が起こることもあり、重い症状が出た時は治療も必要になります。
薬物療法(術後補助化学療法・化学放射線療法)
非小細胞肺がんではm細胞障害性の抗がん剤、それぞれの遺伝子異常に対応する分子標的薬、免疫チェックポイント阻害薬が使われます。
ステージ1~2と3Aの一部で手術可能な症例に対しては、再発予防を目的とした術後補助化学療法として薬物療法が行われます。
ステージ3以降の手術による根治が難しい段階においては、化学療法単独あるいは放射線療法と組み合わせて治療が行われます。使用する薬剤は副作用や患者さんの全身状態を考慮して選択されます。
1)術後補助化学療法
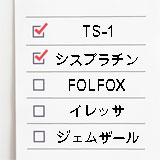
ステージ1A3と2Aの一部の非小細胞肺がんに対しての術後補助化学療法は、テガフール・ウラシル(UFT)を1~2年間服用することが推奨されています。
ステージ2~3Aの非小細胞肺がんに対しては、シスプラチンとビノレルビン(商品名:ナベルビン)を併用したCDDP+VNR療法が推奨されています。ガイドラインで上では、PD-L1発現が50%以上の肺がんに対しては、CDDP+VNR療法後に免疫チェックポイント阻害薬のアテゾリズマブ(商品名:テセントリク)の単剤療法(1年間)が弱く推奨されています。
2)ステージ3の根治照射可能症例の化学療法
ステージ3は、他の臓器への浸潤やリンパ節転移があるものの、肺がんが一定の範囲にとどまっている状態ではありますが、画像検査では写らない微小転移がある可能性があります。
そのため、原発巣とリンパ節には放射線と抗がん剤による治療を行い、微小転移に対しては全身に効果のある抗がん剤治療を行う必要があるため、全身状態が良好な患者さんに対して化学放射線療法が勧められています。
抗がん剤には放射線療法の効果を高める作用もあるため、放射線治療と化学療法を同時に行うことがすすめられています。化学放射線療法後に手術可能と判断された場合は、外科療法を行い、その後再発予防を目的として免疫チェックポイント阻害薬または、抗がん剤治療を行う流れになる場合もあります。
■化学放射線療法で主に用いられるレジメン
| レジメン | 使われる薬剤 |
|---|---|
| CP療法 | カルボプラチン+パクリタキセル |
| CD療法 | シスプラチン+ドセタキセル |
| カルボプラチン療法 ※71歳以上のシスプラチン一括投与が不適な場合 | カルボプラチン |
地固め療法(維持療法)
化学放射線療法で病勢が抑えられている場合、残っている微小がんを徹底的に叩いて、より深い寛解をもたらすために、化学放射線療法後に免疫チェックポイント阻害薬であるデュルバルマブ(商品名:イミフィンジ)による地固め療法が推奨されています。
ステージ4のドライバー遺伝子変異陽性の薬物療法
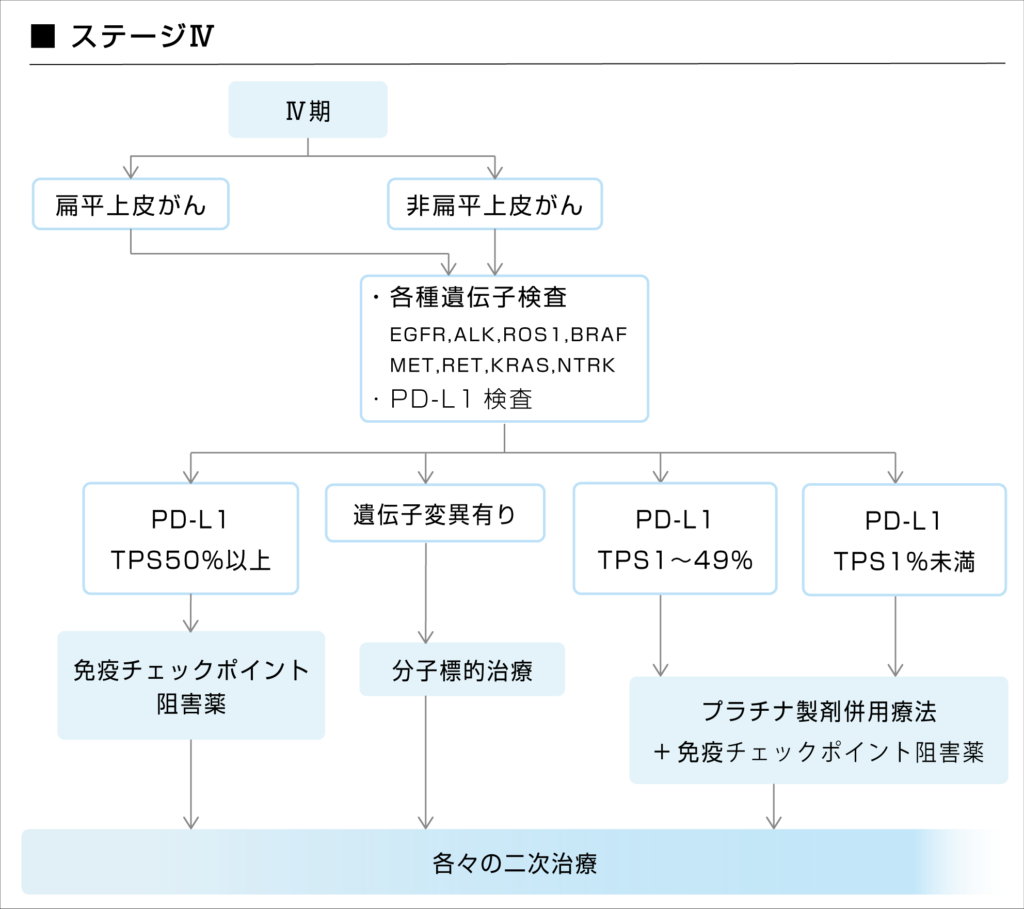
ステージ4の進行肺がんにおいては、手術や放射線などの局所治療は適応とならず、全身に効果のある薬物療法での治療となります。治療前に肺がんの増殖や発生に関わっているドライバー遺伝子を調べ、遺伝子変異が認められた場合は、各ドライバー遺伝子に対する標的療法が行われます。
EGFR遺伝子変異陽性
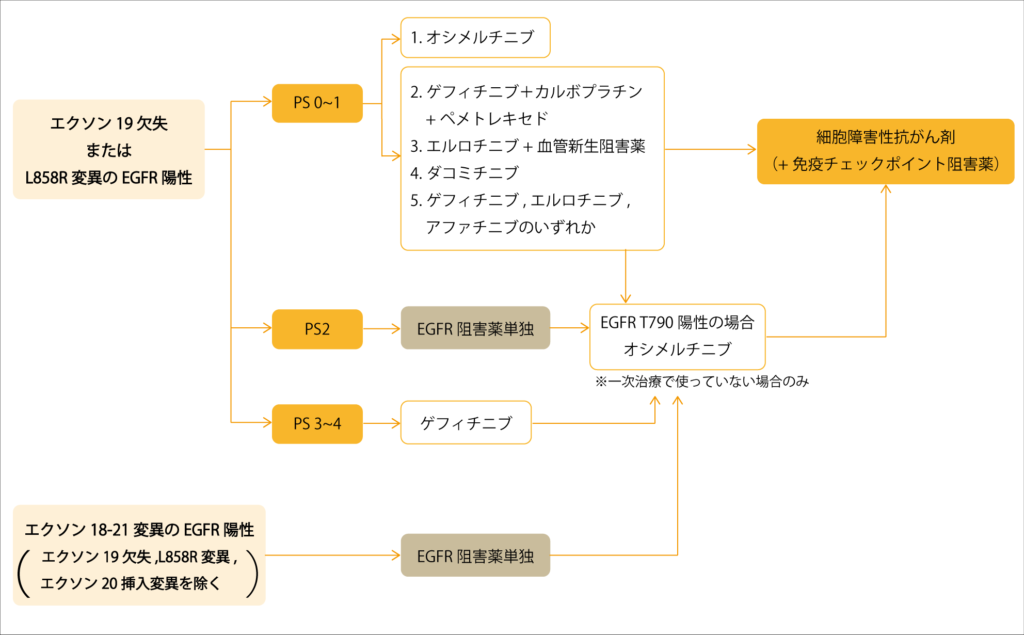
EGFR遺伝子変異は日本人の非小細胞肺がん全体の30~40%で非小細胞肺がんの中でも、特に腺がんの患者さんに多く認められています。
EGFR遺伝子変異には、いくつかの種類があり、特に多いのがEGFR遺伝子中のエクソン19の一部がなくなっている「エクソン19欠失」、エクソン21の塩基の並びが入れ替わっている「L858R変異」です。
EGFR陽性の場合、EGFR阻害薬の高い治療効果が得られるといわれますが、長期間の使用でがんが薬剤耐性を持ち、効果がなくなることもあります。
耐性を生じる原因の一つに新しく「T790M」という遺伝子変異の発現があります。
| EGFR陽性の化学療法レジメン |
|---|
| ・オシメルチニブ(タグリッソ) ・ゲフィチニブ+カルボプラチン+ペメトレキセド ・エルロチニブ+血管新生阻害薬 ・ダコミチニブ ・ゲフィチニブ単独 ・エルロチニブ単独 ・アファチニブ(ジオトリフ)単独 |
ALK融合遺伝子陽性
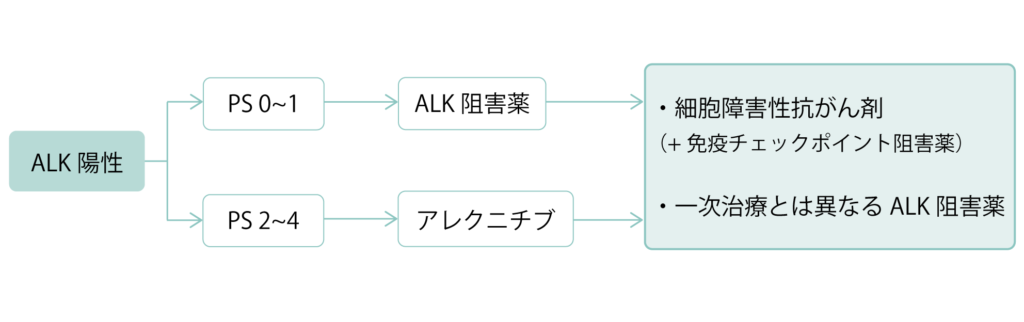
ALK陽性肺がんは非小細胞肺がんの約2~5%で特に腺がんに多くみられます。
ALK陽性肺がんに対しては、ALK阻害薬による治効果が高いといわれています。しかし、ALK阻害薬の効果は無限ではなく、がんが薬剤の耐性を獲得すると効果がなくなってしまいます。その場合は、1回目に使用した薬とは別のALK阻害薬や、細胞障害性の抗がん剤に切り替えられます。
ALK阻害薬は他の薬剤と併用ではなく、基本は単独で使われます。
| 非小細胞肺がんで承認されているALK阻害薬 |
|---|
| ・アレクチニブ(アレセンサ) ・ブリグチニブ(アルンブリグ) ・ロルラチニブ(ローブレナ) ・セリチニブ(ジカディア) ・クリゾチニブ(ザーコリ)※あまり推奨されていない |
ROS1融合遺伝子陽性
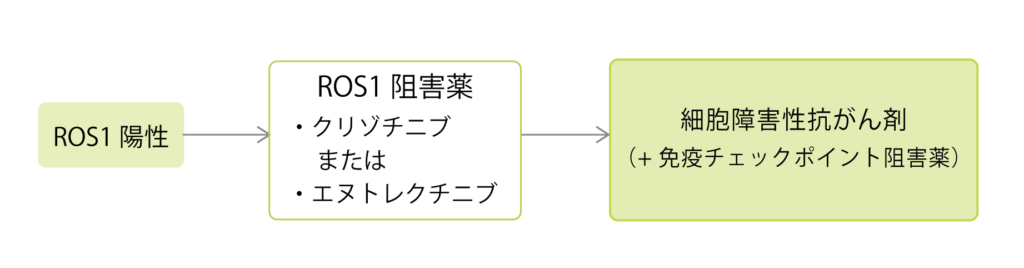
ROS1陽性肺がんの割合は、非小細胞肺がんの中でも1~2%と極めて少なく、治療開発のための臨床試験を行うために充分な数の患者さんを集めることが難しいという問題もあり、他のドライバー遺伝子よりも治療薬は多くはありません。
現在、ROS1陽性肺がんではクリゾチニブ(ザーコリ)とエヌトレクチニブ(ロズリートレク)という2つの分子標的治療薬が承認されており、ROS1陽性となったら、どちらかの薬剤に投与が推奨されています。
BRAF遺伝子変異陽性
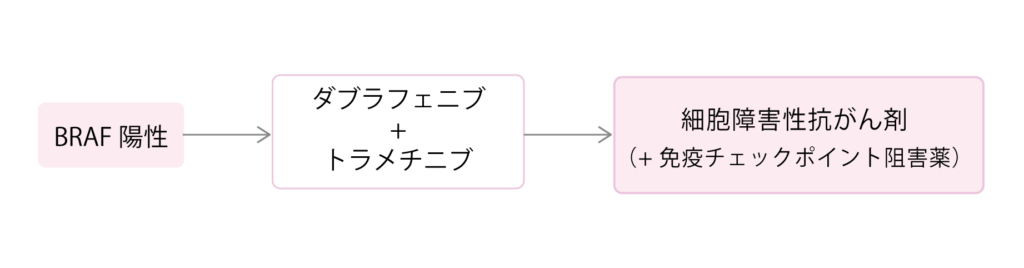
BRAF陽性肺がんは非小細胞肺がんの中でも約1~3%と極めて少ない割合となっています。BRAF陽性肺がんでは、BRAF阻害薬のダブラフェニブ(タフィニラー)とトラメチニブ(メキニスト)の併用療法が推奨されています。
MET遺伝子変異陽性
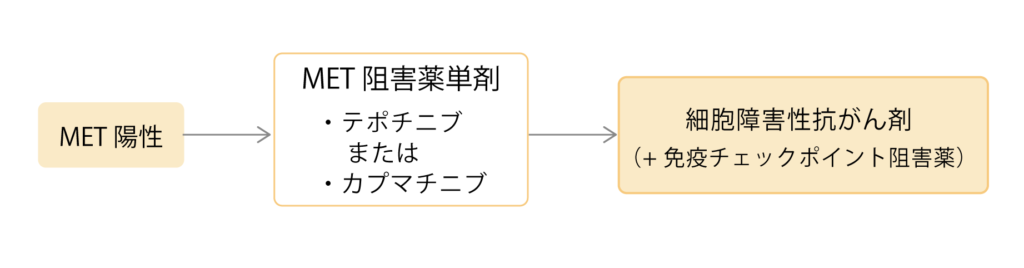
MET遺伝子変異には「METエクソン14欠失」と「METタンパクの増加」の2種類があり、非小細胞肺がんではMETエクソン14欠失変異が約2%でみられます。2023年10月時点でテポチニブ(テプミトコ)とカプマチニブ(ダブレクタ)の2つのMET阻害薬が承認されており、どちらかの薬剤を使用し、効果が得られなくなった場合は細胞障害性抗がん剤に切り替えられます。
RET融合遺伝子陽性
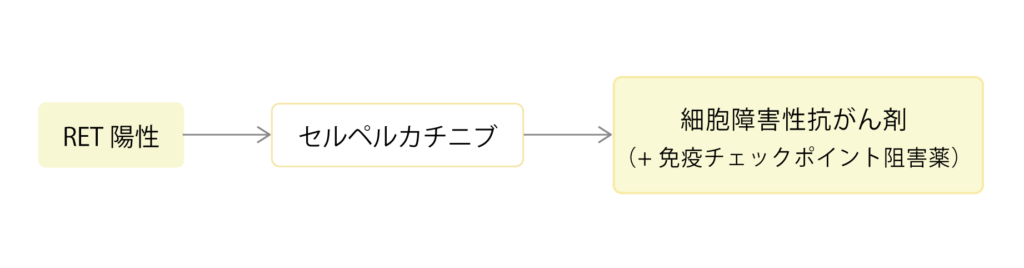
RET融合遺伝子は非小細胞肺がんの約2%にしかみられない希少性のドライバー遺伝子で、男性よりも女性、非喫煙者、若年層に多い傾向にあります。RET陽性肺がんではセルペルカチニブ(レットヴィモ)という内服の分子標的治療薬が承認されています。
NTRK融合遺伝子陽性

神経細胞の分化などに関わるTRKタンパク質を作り出すNTRK遺伝子が他の遺伝子と融合すると、NTRK融合遺伝子となります。
NTRK融合遺伝子から作られるTRK融合タンパク質は、必要のない時も細胞を増殖させてしまうため、これががん細胞の増殖に関わってきます。
そのため、NTRK陽性肺がんに対しては、TRK融合遺伝子の働きを妨げるTRK阻害薬が承認されています。現在はエヌトレクチニブ(ロズリートレク)、ラロトレクチニブ(ヴァイトラックビ)のいずれかの単剤療法がすすめられていますが、両薬剤ともにNTRK陽性の固形癌に対して癌腫横断的に行われた試験結果からの情報、そして実施可能な施設が限られていることから、一次治療ではドライバー遺伝子変異陰性の初回治療を行い、二次治療でTRK阻害薬の投与がすすめられています。
KRAS遺伝子G12C変異陽性

KRASは細胞の増殖や生存において重要な調節因子であり、多くのがんのドライバー遺伝子として特定されています。
非小細胞肺がんでは約4.5%の患者さんでKRAS遺伝子G12C陽性が認められており、分子標的治療薬のソトラシブ(ルマケラス)が承認されています。
現時点では、一次治療はドライバー遺伝子変異陰性の初回治療を行い、二次治療以降でソトラシブ単独療法が推奨されています。
HER2(ERBB2)遺伝子変異陽性
2023年8月に非小細胞肺がんにおいて、HER2陽性肺がんに対する分子標的治療薬としてトラスツズマブ デルクステカン(エンハーツ)が承認されました。非小細胞肺がんへの効能効果として、「がん化学療法後に増悪したHER2(ERBB2)遺伝子変異陽性の切除不能な進行・再発の非小細胞肺癌」となっているため、二次治療以降の投与がすすめられています。
ステージ4のドライバー遺伝子変異/転座陰性
ステージ4でどのドライバー遺伝子変異も陰性だった場合、PD-L1検査の結果とご本人の全身状態(PS)から治療方針が決められます。
PD-L1 TPS 50%以上の治療方針
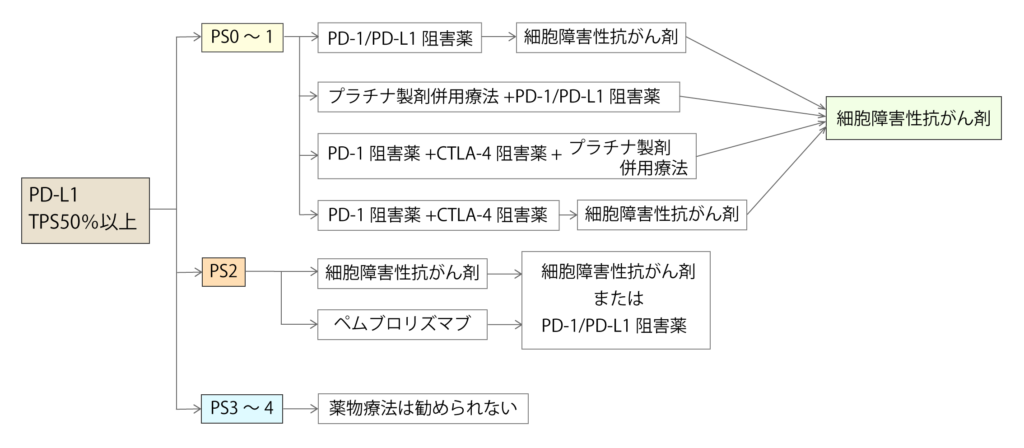
PD-L1 TPS 50%以上の非小細胞肺がんでは、PD-1/PD-L1阻害薬で高い治療効果が期待できます。
PS0~1の全身状態の良い患者さん、PS2の全身状態は良くないが治療ができる体力がある患者さんとで勧められる薬剤は異なります。
PS3~4の全身状態が良くない患者さんには治療は勧められません。
≪PS0~1のPD-L1 TPS 50%以上に対する薬物療法≫
| 使われる薬剤 | |
|---|---|
| PD-1/PD-L1阻害薬単独 | ・ペムブロリズマブ(キイトルーダ) または ・アテゾリズマブ(テセントリク) |
| プラチナ製剤併用療法 +PD-1/PD-L1阻害薬 | [PD-1/PD-L1阻害薬] ・ペムブロリズマブ ・アテゾリズマブ(扁平上皮がん以外) [プラチナ製剤併用療法] ■シスプラチン レジメン ・シスプラチン+ペメトレキセド ・シスプラチン+ドセタキセル ・シスプラチン+ゲムシタビン ・シスプラチン+ビノレルビン ・シスプラチン+イリノテカン ・シスプラチン+S-1 ■カルボプラチン レジメン ・カルボプラチン+パクリタキセル ・カルボプラチン+ゲムシタビン ・カルボプラチン+S-1 ・カルボプラチン+ナブパクリタキセル ・カルボプラチン+ペメトレキセド ■ネダプラチン レジメン ・ネダプラチン+ドセタキセル |
| PD-1阻害薬+CTLA-4阻害薬+プラチナ製剤併用療法 | [PD-1阻害薬]ニボルマブ [CTLA-4阻害薬]イピリムマブ [プラチナ製剤併用療法]“プラチナ製剤併用療法+PD-1/PD-L1阻害薬”を参照 |
| PD-1阻害薬+CTLA-4阻害薬 | ニボルマブ(オプジーボ)+イピリムマブ(ヤーボイ) |
| 細胞障害性抗がん剤 | ・ドセタキセル ・ペメトレキセド ・S-1(テガフール・ギメラシル・オテラシルカリウム) ・ゲムシタビン ・ビノレルビン(ナベルビン) ・ナブパクリタキセル(アブラキサン) |
PD-L1 TPS 1~49%の治療方針
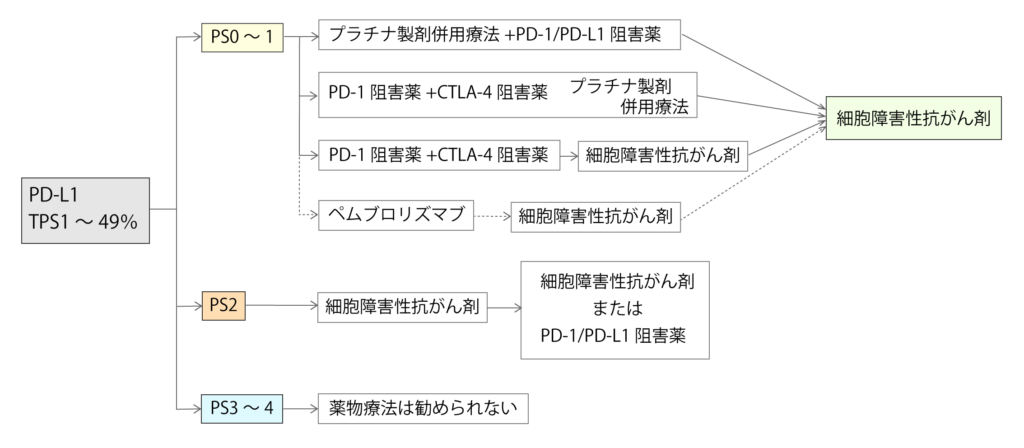
PD-L1 TPSが1~49%の症例では、プラチナ製剤併用療法と免疫チェックポイント阻害薬の併用が第一に推奨されています。
この症例においては、一次治療で免疫チェックポイント阻害薬の単独療法が細胞障害性抗がん剤よりも有効であるかは示されていません。(使われる薬剤は「PS0~1のPD-L1 TPS50%以上に対する薬物療法」の図を参照して下さい。)
PD-L1 TPS 1%未満の治療方針
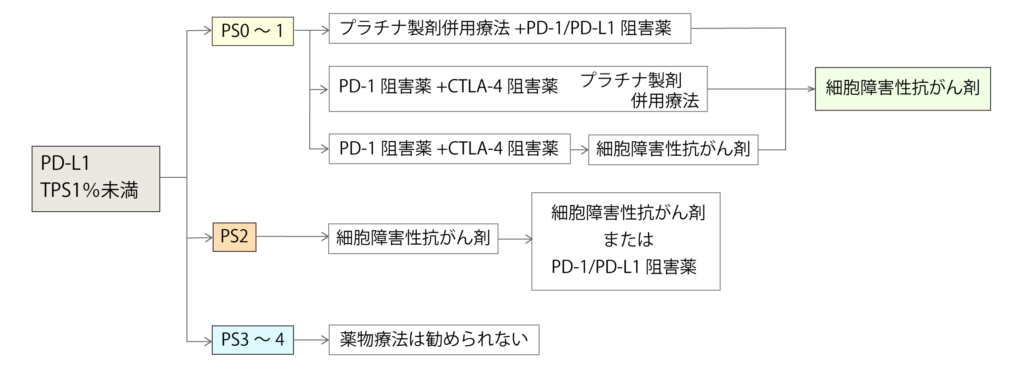
PD-L1 TPS 1%未満の場合は、一次治療でPD-1/PD-L1阻害薬単独での適応がないため、全身状態が良い場合はプラチナ製剤併用療法にPD-1/PD-L1阻害薬を併用した治療が推奨されています。
肺がんの転移などに対する治療
お問い合わせ先
NPO法人日本統合医療推奨協会では、フコイダン療法やがん統合医療についての無料相談窓口を設置しております。
臨床に基づいた飲用方法、がん治療についてのお悩みがございましたら、お気軽にご相談下さい。
お電話が繋がらない場合は、氏名・ご連絡先・お問い合わせ内容をご入力の上info@togoiryou.comまでメール送信下さい。
資料もご用意しております。
フコイダン療法についての無料レポートをご用意しております。お電話または資料請求フォームよりご請求下さい。